Checkliste Klinische Bewertung entsprechend MEDDEV 2.7.1
Im Juni 2016 veröffentlichte die Europäische Kommission einen neuen Entwurf der Leitlinie zur klinischen Bewertung von Medizinprodukten entsprechend den Richtlinien 93/42/EWG und 90/385/EWG. Diese Leitlinien sind zwar rechtlich nicht bindend, es wird allerdings von allen benannten Stellen und zuständigen Behörden die Einhaltung dieses Dokuments gefordert.
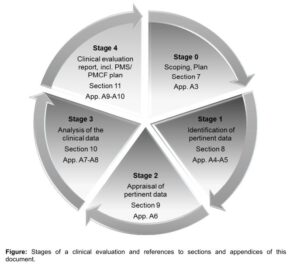
Der Umfang dieses Anforderungskataloges umfasst 65 Seiten und gibt detailliert die Vorgehensweise bei der „Bewertung der Leistungsfähigkeit und Sicherheit“ der jeweiligen Produkte vor. Die Durchführung wird in 5 Phasen (Stage 0 – Stage 4) gegliedert. (Copyright Grafik Europäische Kommission 2016).
Aus dem Anforderungsdokument haben wir einen Fragenkatalog generiert, der den Abgleich vorhandener Bewertungen mit den aktuellen Forderungen erleichtern soll.
CHECKLISTE MEDDEV 2.7.1 klinische Bewertung Medizinprodukte Revision 4
Neuheiten gegenüber der Revision 3 sind unter anderem
Stage 0
die Post market surveillance Planung
Stage 1
Die Identifikation der Daten durch mehrere Recherchestrategien zu Identifikation aller relevanten, positiven und negativen Daten, sowie das Protokoll zur Methodik der Recherche (incl. aller Abweichungen von der ursprünglichen Strategie)
Klärung (z.B. als GAP Analyse) zur Notwendigkeit klinischer Studien
Stage 2
Eine „Gewichtung“ benutzter Literaturquellen, usw.
Stage 3
Risikomanagement, usw.
Stage 4
Zusammenfassung der Recherche-Algorithmen (aller Daten und Schlussfolgerungen)
Im Gegensatz zur 3. Revision sind Details zur Autorenqualifikation hinzugefügt worden. Explizit werden Kenntnisse der wissenschaftlichen Methoden, Kenntnisse über Informationsmanagement und regulatorische Anforderungen (medical writing) gefordert.
Die Interessenerklärung der Autoren (ja, es kann im Team verfasst werden) machen die Umsetzung dieser MEDDEV Leitlinie nicht einfacher. Es wird gefordert, dass ein Verzicht persönlicher und finanzieller Interessen (auch Familienmitglieder) erklärt wird. Ausgenommen ist natürlich die Bewertung an sich.
Einzelheiten können Sie der unterschiede-meddev-2-7-1medizinprodukte-rev-3-rev4 entnehmen.


